|
تضامنًا مع حق الشعب الفلسطيني |
نترات
| نترات | |
|---|---|
 | |
| تسمية الاتحاد الدولي للكيمياء | |
Nitrate |
|
| المعرفات | |
| رقم CAS | 14797-55-8 |
| بوب كيم (PubChem) | 943 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | NO3- |
| الكتلة المولية | 62.0049 g mol-1 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
النترات هو أيون متعدد الذرات، له الصيغة الكيميائية NO3−، يحمل وحدة شحنات سالبة، وكتلته الجزيئية 62.0049 جرام/مول. كما أنه مجموعة وظيفية عضوية RONO2، وتعد إستر النترات من الأنواع الشديدة من المتفجرات.
من النترات أملاح وكذلك إستر وهي تتكون من حمض النتريك (HNO3). تنتمي الأملاح إلى الصيغة الكيميائية MINO3 حيث (MI: كاتيون) أحادي التكافؤ. ويحمل الأنيون NO3− وحدة شحنة سالبة.
أما إستر حمض النتريك فله الصيغة الكيميائية R–O–NO2 ( حيث R : جزيء عضوي ). أحد أنواع الإستر هو نيتروغليسرين وهو مادة شديدة الانفجار، واسمه الكيميائي «ثلاثي نترات الجلسرين».
يتكون أي ملح من أملاح النترات باتحاد ذرة فلز مع أنيون النترات، أما الإستر فهو اتحاد جزيء عضوي مع أنيون النترات.
استخداماته
تستخدم النترات أساسا في إنتاج الأسمدة الزراعية بفضل سهولة ذوبانها في الماء وتحللها الحيوي. النترات الرئيسية هي الأمونيا ونترات الصوديوم ونترات البوتاسيوم ونترات الكالسيوم. ويتم إنتاج عدة ملايين من الكيلو جرامات سنويًا منها لغرض تسميد المزروعات [1]
استخدامات أخرى
تستخدم النترات أيضًا كعوامل مؤكسدة، وعلى الأخص في المتفجرات حيث تؤدي الأكسدة السريعة لمركبات الكربون إلى تحرير كميات كبيرة من الغازات الساخنة. كما تستخدم نترات الصوديوم لإزالة فقاعات الهواء من الزجاج المصهور أثناء صناعة الزجاج وكذلك في بعض أنواع خزف.
تركيبه
| الاسم | الصيغة الكيميائية | أسماء أخرى |
|---|---|---|
| نترات البوتاسيوم | KNO3 | |
| نترات الصوديوم | NaNO3 | |
| نترات الباريوم | Ba(NO3)2 | |
| نترات الكالسيوم | Ca(NO3)2 | |
| نترات الأمونيوم | NH4NO3 | |
| نترات الفضة | AgNO3 | |
| نترات الألمنيوم | Al(NO3)3 | |
| نترات الحديد | Fe(NO3)3 | |
| أمثلة أخرى تجدها تحت تصنيف: نترات | ||
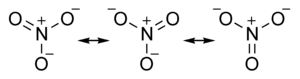
أيون النترات هو أيون مسطح - أي أن كل ذراته تقع في مستوي واحد. الثلاثة زوايا O–N–O فيه تبلغ كل منها 120°. كما أن الربطات N–O الثلاثة متساوية الطول ويبلغ طولها بين طول الترابط الأحادي والترابط الثنائي. لهذا يكون لأيون النترات ثلاثة أنواع من المصاوغة.
تركيب إستر النتريك

كما في الشكل يتكون أستر حمض النتريك بارتباط جزيء عضوي R بجزيء النترات. وقد تكون R أريل أو الكيل أو أريل ألكيل أو غير ذلك. في الشكل تمثل مجموعة النترات باللون الأزرق blau.
خواص النترات
معظم أملاح النترات المعدنية تذوب في الماء في درجة الحرارة والضغط العاديين. ومن أمثلة أملاح النترات الغير عضوية نترات البوتاسيوم ويسمى احيانا «سالبيتر».

ويحصل جسم الإنسان على قدر كبير من النترات الغير عضوية من غذائه الغني بأوراق النباتات الخضراء مثل السبانخ والسلق. وتشير بعض الفحوصات إلى أن غذاء يحتوي على نترات من النباتات يتحول في الجسم إلى أكسيد النتريك ويخفض ضغط الدم العالي.
بعض الرجيم الغذائي الذي يعمل على خفض الضغط العالي، مثل «رجيم داش» DASH diet تزيد من مستوى أكسيد النتريك في الجسم، الذي يختزل أولا إلى نتريت في اللعاب ، ويتضح ذلك من أختبار اللعاب، من قبل أن يتحول إلى أكسيد النتريك.
وجودها

توجد النترات طبيعيا في الجو وفي المياه. كما يوجد منها مناجم للنترات ومعظمها مكون من نترات الصوديوم. توجد مناجم النترات أساسا في تشيلي ولذلك تسميتها «تشيلي سالبيتر». كما توجد منه مناجم في مصر وآسيا الصغرى وكولومبيا وكاليفورنيا.
كما تنتج بعض أنواع البكتيريا نترات مثل بكتيريا النترات. وقد كان إنتاج النترات في البدء عن طريق عملية تخمير البول بغرض صناعة البارود.
وتحضر النترات صناعيا على وجه كبير لإنتاج السماد الاصطناعي.
تكوّن النترات وتحللها
في التربة و المياه تتكون النترات عن طريق بكتيريا من نوع خاص في عملية كيميائية تسمى نترجة.
عند تحلل مادة بروتينية في التربة تنتج مركبات الأمونيا. وهذه تتأكسد تحت فعل بكتيريا من نوع نتروزوموناس فينتج نتريت، ثم يتحول النتريت تحت فعل بكتيريا من نوع «نتروباكتير» إلى نترات، وهي عملية تأكسد.
وفي عدم وجود الأكسجين تقوم البكتريا بعملة إختزال نيتروجيني تتحول فيها النترات إلى نتروجين. تلك التفاعلات تستخدم في محطات تنقية مياه المجاري باستمرار لفصل المركبات النتروجينية من الماء.
تحضير أملاح النترات
تحضر أملاح النترات عن طريق تفاعل حمض النتريك مع هيدروكسيد فلز أو كربونات فلز. في حالة خلط حمض النتريك مع هيدروكسيد الباريوم يتم التفاعل:
- تفاعل حمض النتريك مع هيدروكسيد الباريوم ينتج نترات الباريوم وماء.
- تفاعل حمض النتريك مع كربونات البوتاسيوم تنتج نترات البوتاسيوم وماء وثاني أكسيد الكربون.
- تفاعل حمض النتريك مع الزنك ينتج نترات الزنك، وماء وأول أكسيد النتروجين.
التسميد
تستخدم النباتات النترات كغذاء لها تساعدها على النمو، ولهذا تستخدم النترات في الزراعة لتسميد الأرض. وتستطيع النباتات امتصاص النترات كمصدر للنتروجين لبنائه في هيكلها.
وتوزع النترات في الأراضي الزراعية في هيئة سماد اصطناعي أو أيضًا في روث الماشية حيث أنها تكون غنية بالنترات، وهذا يسمى سماد طبيعي. هذا السماد الطبيعي أو الحيواني يحتوي على تنرات الكالسيوم وكذلك على نترات الأمونيوم وفوسفات الأمونيوم، وغالبا في صورة مركبات نتروجينية (مثل البروتينات وعن طريق النترجة ينشأ في التربة من أيونات الأمونيوم (NH4+) نتريت ثم يتحول النتريت إلى نترات عن طريق أنواع من البكتيريا تقوم بذلك.
وبسبب زيادة في تسميد الأرض في بعض البلاد الأوروبية بسماد طبيعي حيواني متزايد بالإضافة إلى استخدام بقايا عملية إنتاج الغاز الحيوي ورشها في المزارع فقد زادت نسبة النترات في التربة في بعض المناطق وتسربت النترات إلى المياه الجوفية، مما له تأثير سيئ على مياه الشرب. لهذا يعمل الاتحاد الأوروبي على تحديد معايير لتسميد الأراضي وإلزام المزارعين بها.
تاثير النترات على الصحة

إن الخطورة على الصحة تتعلق باختزال النترات في الجسم وتحولها إلى نتريت وهي مادة تتحول إلى نتروزامين وتتسبب في السرطان. تحدث هذه التحولات في الامعاء عن طريق بكتيريا، كما أن اللعاب في الفم يمكنه اختزال النترات الموجودة في الطعام ( في السجق والحوم المشوية شديدا) وتصل بعد ذلك إلى الدم .[2]
كذلك تعمل البكتيريا الموجودة في أمعاء الرضع، كما هو الحال أيضا مع الكبار، على اختزال النترات إلى نتريت. ويؤكسد النتريت هيموجلوبين الدم ويحوله إلى مادة تسمى «ميتهيموجلوبين» ولا يستطيع جسم الرضيع إعادة اختزال الميتهيموجلوبين إلى هيموجلوبين المتكون فيختنق داخليا.
كما أن الماشية والحيوانات المجترة تختزل النترات في معدتها مما يزيد من النترات في جسمها. وبالنسبة إلى مياه الشرب فتنصح اللجنة المتخصصة في الاتحاد الأوروبي بأن يكون تركيز النترات أقل من 20 مليجرام/اللتر.
نترات في مياه الشرب
يحدد القانون الألماني تركيز النترات NO3− في مياه الشرب بـ 50 مليجرام/لتر، ويحدده القانون السويسري بـ 40 مليجرام/لتر.[3] وفي النمسا يحدد القانون 50 مليجرام/لتر.[4] وتعمل محطات مياه الشرب على خلط مياه محتوية على أكثر من هذا الحد بمياه فقيرة في نسبة النترات بغرض الحفاظ على التركيز الذي يحدده القانون. في الفترة الأخيرة تقوم بعض محطات مياه الشرب بتحلية المياه عن طريق التناضح العكسي أو بواسطة الترشيح النانوي Nanofiltration بغرض خفض كمية النترات في مياه الشرب.
لا تشكل النترات في حد ذاتها خطرا على الصحة إذا كانت في الحدود التي يقرها القانون. ولكن الخطر يقع بالنسبة للصغار الرضع ولبعض الناس الذي يكون في امعائهم بكتيريا غير معتادة فتتحول النترات إلى نتريت.
ومن المهم معرفة ان الحدود التي يقرها القانون بالنسبة لتركيز النترات في مياه الشرب فإنها تمثل الحد الأعلى لوجود مركبات نتروجينية عالقة بمياه الشرب، فالأفضل أن يكون تركيز النترات في مياه الشرب أقل من ذلك.
طالع أيضًا
المراجع
- ^ Wolfgang Laue, Michael Thiemann, Erich Scheibler, Karl Wilhelm Wiegand "Nitrates and Nitrites" in Ullmann's Encyclopedia of Industrial Chemistry, 2006, Wiley-VCH, Weinheim. دُوِي:10.1002/14356007.a17_265
- ^ Martin Ledig, Georg Wittke: Nitrat in Lebensmitteln (PDF; 147 kB), In: Naturwissenschaften im Unterricht - Chemie, 5(1994), 23, S. 7-9. نسخة محفوظة 31 يناير 2012 على موقع واي باك مشين. [وصلة مكسورة]
- ^ BAFU/BAG (Hrsg.): Umwelt und Gesundheit in der Schweiz. Eine facettenreiche Beziehung (= Umwelt-Zustand. Nr. 1908). Bern 2019, S. 23 (https://www.bafu.admin.ch/dam/bafu/de/dokumente/gesundheit/uz-umwelt-zustand/umwelt-und-gesundheit.pdf.download.pdf/UZ-1908-D_UmweltGesundheit.pdf [PDF; 5,1 MB; abgerufen am 19. November 2019]). نسخة محفوظة 10 سبتمبر 2021 على موقع واي باك مشين.
- ^ Gesamte Rechtsvorschrift für Trinkwasserverordnung, Fassung vom 20.02.2014 نسخة محفوظة 24 مايو 2017 على موقع واي باك مشين.
| نترات في المشاريع الشقيقة: | |