|
تضامنًا مع حق الشعب الفلسطيني |
كلوريد الكروميل
| كلوريد الكروميل | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
ثنائي كلوريد ثنائي أكسيد الكروم السداسي |
|
| أسماء أخرى | |
كلوريد الكروميل |
|
| المعرفات | |
| رقم CAS | 14977-61-8 |
| الخواص | |
| الصيغة الجزيئية | CrO2Cl2 |
| الكتلة المولية | 154.9008 غ/مول |
| المظهر | سائل أحمر اللون |
| الكثافة | 1.911 غ/سم3 سائل |
| نقطة الانصهار | -96.5 °س |
| نقطة الغليان | 117 °س |
| الذوبانية في الماء | يتفكك |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
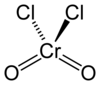
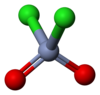
كلوريد الكروميل مركب كيميائي له الصيغة CrO2Cl2، ويكون على شكل سائل له لون أحمر قانئ.
التحضير
يحضر كلوريد الكروميل من تفاعل حمض هيدروكلوريك مع أكسيد الكروم السداسي أو مع حمض الكروميك حسب المعادلة:
CrO3 + 2HCl → CrO2Cl2 + H2O
أو من تفاعل كرومات البوتاسيوم مع حمض هيدروالكلوريك المركز، يتبع ذلك إضافة حمض الكبريتيك من أجل إزالة الماء من الوسط. يكون من السهل إجراء عملية فصل لكلوريد الكروميل الناتج حيث يكون يفصل على شكل سائل كثيف غير مزوج وذلك بواسطة قمع فصل أو بالتقطير.
يمكن تحضير كلوريد الكروميل بطريقة أخرى أيضاً وذلك باستعمال كواشف أخرى مكلورة مثل خماسي كلوريد الفوسفور PCl5 ورباعي كلوريد التيتانيوم TiCl4 أو بإضافة حمض الكبريتيك المركز إلى مزيج من كلوريد الصوديوم وثنائي كرومات البوتاسيوم، يلي ذلك إجراء عمليية تقطير.[2]
K2Cr2O7 + 4NaCl + 6H2SO4 → 2CrO2Cl2 + 2KHSO4 + 4NaHSO4 +3H2O
الخواص
- للمركب بنية جزيئية رباعية الوجوه مثل أيون الكرومات −2[CrO4] إلا أنهما يختلفان عن بعضهما بقوى الأكسدة وبالحالة الفيزيائية. إن مركب كلوريد الكروميل معتدل لا يحمل شحنة كهربائية، أي أن الجزيئات مرتبطة مع بعضها البعض بقوى فان دير فالس الضعيفة، لذلك فإن المركب يكون بالحالة السائلة يمكن تقطيره.
- يتميز كلوريد الكروميل بخواصه المؤكسدة القوية جداً، كما أنه من الكواشف المحبة للإلكترونات، فهو يخضع لتفاعل حلمهة بشكل مباشر عند التماس مع الماء فيتشكل حمض الكروميك وحمض هيدروكلوريك حسب المعادلة:
- CrO2Cl2 + 2H2O → H2CrO4 + 2HCl
- وتبلغ درجة الحساسية تجاه الماء أن المركب يدخن في جو من الهواء الرطب.
- يجب اختيار المحل العضوي المناسب، فالكحولات (الأغوال) غير ملائمة حيث يتفكك فيها. يعد ثنائي كلورو الميثان من الخيارات الجيدة.
الاستخدامات
- يستعمل تفاعل تحضير كلوريد الكروميل في الكيمياء التحليلية من أجل الكشف عن الكلوريدات. تسخن العينة التي يشك بوجود الكلوريد فيها مع ثنائي كرومات البوتاسيوم وحمض الكبريتيك المركز. في حال وجود أيونات الكلوريد في العينة فإن كلوريد الكروميل سيتشكل بالأبخرة الحمراء المميزة. في حال عدم وجود الكلوريد فلن تتشكل تلك الأبخرة. هذا الاختبار حصري بأيونات الكلوريد، إذ أن الفلوريدات والبروميدات واليوديدات والسيانيدات لا تقوم بفعل مشابه.
- حسب نوع المحل المستخدم فإن كلوريد الكروميل الألكينات الطرفية (الرابطة المضاعفة على طرف السلسة) إلى ألدهيدات، في حين أن الألكينات الداخلية تعطي مركبات ألفا-كلورو الكيتون أو مشتقات مشابهة.[3] يستعمل كلوريد الكروميل أيضاً كحفاز في تفاعل ايتار Étard reaction.
السلامة
يجب التعامل بحذر مع مركب كلوريد الكروميل فهو يشكل حمض هيدروكلوريك المخرش بالتماس مع الهواء الرطب، مما يؤدي إلى تخرش جهاز التنفس ويهيج العينين، ويحرق الجلد، كما أن ابتلاعه يؤدي إلى أضرار داخلية جسيمة.[4] بالإضافة إلى ذلك فإن المركب يعطي الكروم السداسي CrVI والذي يسبب اضطراب صبغي كما أنه مسرطن.[5]
طالع أيضاً
المراجع
- ^ Chromyl chloride ≥99.99% trace metals basis | Sigma-Aldrich نسخة محفوظة 22 يوليو 2020 على موقع واي باك مشين.
- ^ Moody, B.J. "22". Comparative Inorganic Chemistry (بالإنجليزية) (1 ed.). London: Edward Arnold. p. 381.
- ^ F. Freeman, R. H. DuBois, T. G. McLaughlin."Aldehydes by Oxidation of Terminal Olefins with Chromyl Chloride: 2,4,4-Trimethylpentanal". Org. Synth.; Coll. Vol. 6: 1028.
- ^ Prof CH Gray (ed.). "IV". Laboratory Handbook of Toxic Agents (بالإنجليزية) (2 ed.). London: Royal Institute of Chemistry. p. 79.
- ^ IARC (5 نوفمبر 1999) [1990]. Volume 49: Chromium, Nickel, and Welding (PDF). ص. 21–23. مؤرشف من الأصل (PDF) في 2009-11-14. اطلع عليه بتاريخ 2008-03-26.
| في كومنز صور وملفات عن: كلوريد الكروميل |



