|
تضامنًا مع حق الشعب الفلسطيني |
كلوريد الأسيتيل
اذهب إلى التنقل
اذهب إلى البحث
| كلوريد الأسيتيل Acetyl chloride | |
|---|---|
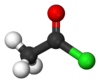 |
 |
| الاسم النظامي (IUPAC) | |
Acetyl chloride |
|
| تسمية الاتحاد الدولي للكيمياء | |
Ethanoyl chloride |
|
| أسماء أخرى | |
acyl chloride |
|
| المعرفات | |
| رقم CAS | 75-36-5 |
| بوب كيم (PubChem) | 6367 |
| الخواص | |
| الصيغة الجزيئية | C2H3ClO |
| الكتلة المولية | 78.49 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 1.10 غ/سم3 |
| نقطة الانصهار | −112 °س |
| نقطة الغليان | 51 °س |
| الذوبانية في الماء | يتفاعل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
كلوريد الأسيتيل هو مركب عضوي ينتمي إلى مجموعة كلوريدات الأحماض الكربوكسيلية، إذ هو كلوريد حمض الأسيتيك. للمركب الصيغة الكيميائية CH3COCl، ويكون على شكل سائل عديم اللون له رائحة واخزة.
التحضير
يحضر كلوريد الأسيتيل من أنهيدريد الأسيتيك مع كلوريد الكالسيوم. كما يمكن أن يتم التحضير من تفاعل حمض الأسيتيك مع ثلاثي كلوريد الفوسفور PCl3. يمكن استخدام كواشف كيميائية أخرى غير PCl3 مثل كلوريد الثيونيل SOCl2 أو خماسي كلوريد الفوسفور PCl5، ولكنها تعطي مردود أضعف،[1] كما أن النواتج تكون ملوثة بآثار من الكبريت أو الفوسفور.[2]

الخصائص
- يكون كلوريد الأسيتيل في الشروط العادية من الضغط ودرجة الحرارة على شكل سائل عديم اللون، له رائحة واخزة.
- يتفاعل المركب بعنف عند التماس مع الماء، حيث يتحرر كلوريد الهيدروجين HCl.
الاستخدامات
- يستخدم كلوريد الأسيتيل بشكل واسع في تفاعلات الأستلة، مثل أستلة فريدل-كرافتس.[3]
- يستخدم في الاصطناع العضوي من أجل تحضير أنهيدريد الأسيتيك:

طالع أيضاً
المراجع
- ^ Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 439f.(بالألمانية)
- ^ Leo A. Paquette (2005). "Acetyl chloride". Handbook of Reagents for Organic Synthesis, Activating Agents and Protective Groups. John Wiley & Sons. ص. 16.
- ^ Charles Merritt, Jr and Charles E. Braun "9-Acetylanthracene" Org. Synth. 1950, 30, 2. دُوِي:10.15227/orgsyn.030.0001
| في كومنز صور وملفات عن: كلوريد الأسيتيل |

