|
تضامنًا مع حق الشعب الفلسطيني |
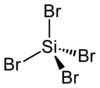
رباعي بروميد السيليكون
| رباعي بروميد السيليكون | |
|---|---|
| الاسم النظامي (IUPAC) | |
Silicon tetrabromide |
|
| أسماء أخرى | |
Tetrabromosilane |
|
| الخواص | |
| الصيغة الجزيئية | SiBr4 |
| الكتلة المولية | 347.72 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 2.8 غ/سم3 |
| نقطة الانصهار | 5 °س |
| نقطة الغليان | 154 °س |
| الذوبانية في الماء | يتفاعل |
| المخاطر | |
| رمز الخطر وفق GHS |  |
| وصف الخطر وفق GHS | خطر |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
رباعي بروميد السيليكون (أو رباعي برومو السيلان) هو مركب كيميائي صيغته SiBr4، ويوجد على شكل سائل عديم اللون.
التحضير
يحضر المركب من تفاعل عنصر السيليكون مع بروميد الهيدروجين عند الدرجة 600 °س:[1]
كما يمكن أن يحضر من التفاعل مع عنصر البروم أيضاً:[2]
الخواص
يوجد المركب في الشروط القياسية على شكل سائل عديم اللون، وهو يتفكك من التفاعل مع الماء عند التماس معه.[3]
يصنف المركب ضمن أحماض لويس؛[4] على الرغم من رباعي هاليدات السيليكون تحقق قاعدة الثمانيات، إلا أنها قادرة على إضافة ربيطات (L) قواعد لويس لتعطي ناتج إضافة من النمط SiBr4L و SiBr4L2.[5][6][7]
الاستخدامات
يؤدي التحلل الحراري للمركب إلى الحصول على السيليكون بدرجة نقاوة جيدة.[8]
طالع أيضاً
المراجع
- ^ Schumb, W. B. Silicobromoform" Inorganic Syntheses 1939, volume 1, pp 38-42. دُوِي:10.1002/9780470132326.
- ^ Georg Brauer (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 671
- ^ Encyclopedia of Inorganic Chemistry; King, B. R.; John Wiley & Sons Ltd.: New York, NY, 1994; Vol 7, pp 3779–3782.
- ^ Davydova, E. I.; Timoshkin, A. Y.; Sevastianova, T. N.; Suvorov, A. V.; Frenking, G. J. Mol. Struct. 2006, vol, 767-1-3. دُوِي:10.1016/j.theochem.2006.05.011
- ^ Beattie, I. R.; Gilson, T.; Webster, M.; (in part) McQuillan, G. P. J. Chem. Soc. 1964, 238-244. دُوِي:10.1039/JR9640000238
- ^ Mironov, S. L.; Gorlov, Y. I.; Chuiko, A. A. Theor. Exp. Chem. 1979, vol, 14–16. دُوِي:10.1007/BF00519073
- ^ Beattie, I. R.; Ozin, G. A. J. Chem. Soc., Inorg. Phys. Theor. 1969, 2267–2269
- ^ Silicon Compounds, Inorganic. Simmler W.; Ullmann's Encyclopedia of Industrial Chemistry; Wiley-VCH, 2002. دُوِي:10.1002/14356007.a24_001
| رباعي بروميد السيليكون في المشاريع الشقيقة: | |