|
تضامنًا مع حق الشعب الفلسطيني |
مسعر
مسعر |
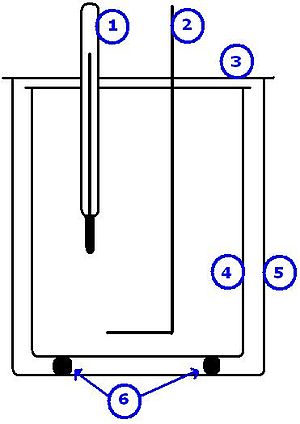
1) ترمومتر
2) سلك للتقليب
3)غطاء عازل
4) وعاء داخلي (معزول)
5) وعاء خارجي
6) عوازل حرارية.

المِسعَر[1] هو جهاز يستخدم في المختبرات الكيميائية لقياس كمية الحرارة الناتجة عن التفاعلات الكيميائية أو الحرارة الناتجة عن تغيرات فيزيائية مثل تحول طوري، بالإضافة إلى قياس الحرارة النوعية للمواد.[2][3]
يسمى المِسعَر بالإنجليزية Calorimeter وهي تعني باللاتينية قياس الحرارة، أما التسمية العربية فمشتقة من السعرة الحرارية التي تقابل Calorie. في عام 1892 ابتكر «هوجو يونكرز» الألماني مسعر وقام بتسجيله للاحتفاظ بحقوق اختراعه، واستخدمه كجهاز لقياس القيمة الحرارية للغازات القابلة للاحتراق.
من ماذا يتكون المسعر: يتكون المسعر من إنائين من فلز كالألمنيوم أو النحاس، إحداهما لإدخال ميزان حرارة، ولأخرى لإدخال أداة لتحريك الخليط ويتم تبادل الطاقة الحرارية بين المواد المخلوطة داخل المسعر، ويحدث كذلك تبادل للطاقة مع الجدار الداخلي للمسعر، بينما يقوم العازل والجدار الخارجي للمسعر بمنع انتقال الحرارة من المخلوط الحراري إلى الوسط المحيط، أو بالاتجاه المعاكس.
مبدأ عمله
يعتمد على قانون حفظ الطاقة في نظام مغلق والمعزول بحيث لا تدخل حرارة من الخارج إلى النظام ولاتخرج منه حرارة إلى الوسط المحيط.
آلية عمله
حساب التغير في الطاقة الحرارية للمادة المسخنة في المسعر وذلك من خلال الزيادة الحاصلة في درجة حرارة الماء في المسعر وكمية الماء والحرارة النوعية للماء. تقاس الحرارة بوحدة جول.
يقيس المسعر كمية الحرارة الناتجة من تفاعل كيميائي في نظام معزول به كمية معلومة من الماء مثلا. وبمعرفة كمية الماء والحرارة النوعية () للماء وبقياس الارتفاع في درجة الحرارة () الحادثة من التفاعل يمكن حساب كمية الحرارة الناشئة () من التفاعل بالمعادلة:
ضرب m:
وتعريف الحرارة النوعية C هي أنها كمية الحرارة اللازمة لرفع درجة حرارة 1 جرام من المادة درجة واحدة (بين 14 - 15 مئوية).
أنواعه
تستعمل أنواع أخرى من المِسعَر لقياس الحرارة الناتجة من تفاعل كيميائي وكذلك لقياس محتوى الأطعمة من الطاقة (السعرات).
مسعر تغير درجة الحرارة
يكون المسعر معزولا عن الوسط المحيط. ويمكن إجراء التبادل الحراري باستخدام سائل (في المسعر السائلي) أو باستخدام معدن (في مسعر معدني). وتلك المسعرات هي أكثر المسعرات استخداما في المعامل الكيميائية. بإتقان العمل به يمكن التوصل إلى دقة قياس تصل إلى 0,01 %. تستخدم هذه المسعرات عندما يستغرق التبادل الحراري 20 دقيقة على الأكثر.
مسعر سائلي
يتكون المسعر الذي يعمل بسائل من وعاء داخل وعاء من النحاس ويملأ الفراغ بينهما بالماء ويعمل على الاحتفاظ بدرجة حرارة ثابتة داخل المسعر. الوعاء الداخلي مصنوع من النحاس الرقيق ويستند على الوعاء الخارجي على عوازل حرارية. ويستخدم الماء عادة كسائل للمسعر، كما يمكن استخدام سوائل أخرى. وعن طريق أداة التقليب يمكن تسريع عملية الانتقال الحراري. ويقاس التغير الحادث في درجة الحرارة بواسطة الترمومتر. (أنظر أيضا مسعر قنبلي لقياس القيمة الحرارية).
مسعر أديباتي
في هذا النوع من المسعرات يحتفظ بفرق درجة الحرارة بين سائل المسعر وسائل الوعاء الخارجي ثابتا عن طريق التسخين أو التبريد بالمعدل الجاري. ويجب أن يسير التسخين أو التبريد بنفس السرعة للاختفاظ بفرق درجتي الحرارة ثابتا. ويسهل إجراء ذلك عندما يكون إنتاج الحرارة في المسعر بطيئا (بين 20 - 60 دقيقة).
مسعر درجة الحرارة الثابتة
في تلك المسعرات تعين كمية الحرارة الناتجة من مواد معينة يحدث فيها تحول طوري. ويحتفظ بدرجة الحرارة أثناء هذا التحول ثابتة. وتسمى تلك المسعرات أيضا مسعرات تحول الطور. وتستخدم عندما يكون التحول الطوري بطيئا، وقد يستغرق عدة ساعات.
مسعر الثلج

يعتبر القياس عند درجة الصفر المئوي في هذا المسعر من أدق المسعرات. وتعمل كمية الحرارة الناتجة من تفاعل كيميائي مثلا على صهر كمية من الثلج. ونظرا لأن حرارة الانصهار للماء معروفة فيمكن من كمية الماء المتكون من الثلج حساب الحرارة الناتجة. ابتكر «لافوازييه» هذا النوع من المسعرات عام 1782. وهو يتكون من وعاء داخلي بشكل القمع ويحيطة وعاء آخر خارجي.
لتحضير عملية القياس يملأ الفراغ بين الوعائين بالماء المقطر، ويملأ الوعاء الخارجي بمخلوط من ثلج، بحيث تتكون طبقة ثلجية على جدران الوعاء الداخلي. ثم يزال مخلوط الثلج والماء الذي لم يتجمد ويصبح المسعر عند نقطة انصهار الثلج. ثم توضع العينة المراد تعيين كمية حرارتها في الوعاء الداخلي ويغلق غطاء المسعر. فيسيل الماء الناتج من انصهار الثلج من صنبور في قاع الوعاء الداخلي بالمقدار المتناسب مع الحرارة الناتجة ويقاس حجمه.
بمعرفة كمية الماء الناتجة بالجرام وحرارة انصهار الثلج يمكن حساب كمية الحرارة الناتجة من العينة، طبقا للمعادلة المذكورة أعلاه.
مسعر التكثيف
يسمى هذا المسعر أيضا «المسعر البخاري» ويستخدم لتعيين الحرارة النوعية لمادة بين 100 - 20 درجة مئوية ويستخدم البخار للتكثيف.
يعلق الجسم المراد قياسه على ميزان حساس بواسطة سلك رفيع ويكون داخل المسعر. ثم يسمح لبخار الماء بالمرور عليه فيتكثف جزء من بخار الماء عليه الذي كان أولا باردا، حتى تصل درجة حرارة الجسم إلى درجة حرارة البخار. يكتسب الجسم من البخار كمية حرارة قدرها ΔQ=r·m.
حيث :(ΔQ == كمية الحرارة; r = حرارة التكثف [تساوي حرارة غليان الماء] ; m == كتلة البخار المتكثف على الجسم).
لعدم السماح بتساقط الماء المتكثف عمن على الجسم يمكن جمعها في بوتقة رقيقة من البلاتين أسفله. يمكن بتلك الطريقة تعيين الحرارة النوعية لمادة بدقة عالية.
مراجع
- ^ Q112315598، ص. 182، QID:Q112315598
- ^ C80 Calorimeter from Setaram Instrumentation نسخة محفوظة 26 مايو 2015 على موقع واي باك مشين.
- ^ Buchholz، Andrea C؛ Schoeller، Dale A. (2004). "Is a Calorie a Calorie?". American Journal of Clinical Nutrition. ج. 79 ع. 5: 899S–906S. PMID:15113737. مؤرشف من الأصل في 2010-10-05. اطلع عليه بتاريخ 2007-03-12.
انظر أيضا
| في كومنز صور وملفات عن: مسعر |
