|
تضامنًا مع حق الشعب الفلسطيني |
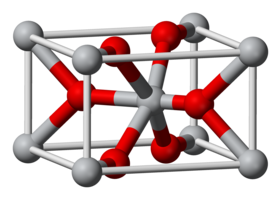
أكسيد المنغنيز الرباعي
| أكسيد المنغنيز الرباعي | |
|---|---|
| الاسم النظامي (IUPAC) | |
أكسيد المنغنيز الرباعي |
|
| أسماء أخرى | |
ثنائي أكسيد المنغنيز |
|
| المعرفات | |
| رقم CAS | 1313-13-9 |
| بوب كيم (PubChem) | 14801 |
| الخواص | |
| الصيغة الجزيئية | MnO2 |
| الكتلة المولية | 86.94 غ/مول |
| المظهر | صلب أسود |
| الكثافة | 5.03 غ/سم3 |
| نقطة الانصهار | 535 °س يتفكك |
| الذوبانية في الماء | غير منحل |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
أكسيد المنغنيز الرباعي أو ثنائي أكسيد المنغنيز عبارة عن مركب كيميائي له الصيغة MnO2، ويكون على شكل مسحوق بلوري أسود. للمركب حالة أكسدة مقدارها +4.
الخواص
- لا ينحل أكسيد المنغنيز الرباعي في الماء، كما أنه لا ينحل لا في حمض الكبريتيك أو حمض النتريك، إلا أنه يتفاعل مع حمض الهيدروكلوريك محررا غاز الكلور ومشكلاً مركب كلوريد المنغنيز الثنائي.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
- عند تسخين المركب فوق 450°س يتفكك إلى أكسيد المنغنيز الثلاثي مع إطلاقه لغاز الأكسجين حسب المعادلة:
4MnO2 → 2Mn2O3 + O2
أما التسخين فوق الدرجة 600°س فإنه بالإضافة إلى انطلاق الأكسجين يعطي أكسيد المنغنيز الثنائي والثلاثي:
3MnO2 → Mn3O4 + O2
الوفرة الطبيعية والتحضير
يوجد أكسيد المنغنيز الرباعي طبيعياً في معدن بيرولوسيت Pyrolusite الذي لديه بنية بلورية معينية قائمة، إلا أنه غالباً ما يكون مترافقاً بوجود شوائب من عناصر أخرى كالحديد مثلاً. تتطلب العديد من التطبيقات الصناعية لأكسيد المنغنيز الرباعي وجوده بحالة نقية، لذلك ينقى إما كهربائياً أو كيميائياً.
يحضر المركب مخبرياً من تفاعل احتراق نترات المنغنيز الثنائي بوجود الهواء فوق 500°س.
Mn(NO3)2 . 6H2O → MnO2 + 2NO2 + 6H2O
الاستخدامات
- يستخدم أكسيد المنغنيز الرباعي مهبط في البطاريات الجافة مثل البطارية القلوية وبطارية زنك - كربون.[2]
- له استخدامات كخضاب كما يستعمل لتحضير مركبات المنغنيز الأخرى.
- يستخدم في بعض عمليات الاصطناع العضوي كمادة مؤكسدة، مثل أكسدة الكحولات الأليلية.
انظر أيضا
المراجع
- ^ البيانات الكيميائية من Sigma-Aldrich نسخة محفوظة 1 مايو 2020 على موقع واي باك مشين.
- ^ Greenwood, Norman N.; Earnshaw, A. (1984), Chemistry of the Elements, Oxford: Pergamon, pp. 1218–20, ISBN 0-08-022057-6 .
| أكسيد المنغنيز الرباعي في المشاريع الشقيقة: | |