|
تضامنًا مع حق الشعب الفلسطيني |
بالاديوم
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فلزي
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | بالاديوم، 46، Pd | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز انتقالي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 10، 5، d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 106.42 غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Kr]؛ 4d10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 18 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 12.023 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 10.38 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 1828.05 ك، 1554.9 °س، 2830.82 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 3236 ك، 2963 °س، 5365 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 16.74 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 362 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 25.98 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 0, +1, +2, +4, +6 (أكاسيده قاعدية ضعيفة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 2.20 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 804.4 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1870 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 3177 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 137 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 139±6 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 163 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | مكعب مركزي الوجه | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية مسايرة[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 105.4 نانوأوم·متر (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 71.8 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 11.8 ميكرومتر·متر−1·كلفن−1 (25 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | 3070 متر/ثانية (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 121 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 44 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 180 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.39 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 4.75 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة فيكرز | 461 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 37.3 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7440-05-3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر البالاديوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
البالاديوم عنصر كيميائي من الجدول الدوري، ورمزه Pd ، وله العدد الذري 46. وهو فلز انتقالي نادر، من مجموعة البلاتين وهو لديه أدنى نقطة انصهار وأقل كثافة منها. ويشبه البلاتين كيميائياً. ويستخرج من خامي النحاس والنيكل. ويستخدم كعامل مساعد وفي صناعة المجوهرات وفي مجال طب الأسنان و هو معدن أبيض فضي لامع نادر .
الاكتشاف

لاحظ وليام هايد ولاستون اكتشاف معدن نبيل جديد في يوليو 1802 في كتابه المختبري وسماه بالاديوم في أغسطس من نفس العام. نقّى ولاستون بما فيه الكفاية من المواد وقدمها، دون تسمية المكتشف، في متجر صغير في سوهو في أبريل 1803. بعد انتقادات قاسية من ريتشارد تشينيفيكس أن البلاديوم هو سبيكة من البلاتين والزئبق، عرض ولاستون مكافأة قدرها 20 جنيهًا بريطانيًا مقابل 20 حبة من سبيكة البلاديوم الاصطناعية.[2] حصل تشنيفيكس على وسام كوبلي في 1803 بعد أن نشر تجاربه على البلاديوم. نشر وولاستون اكتشاف الروديوم في 1804 وذكر بعض أعماله على البلاديوم.[3][4] كشف وولاستون أنه هو مكتشف البلاديوم في منشور في عام 1805.[2][5]
سمّى وولاستون في عام 1802 المعدن الجديد المُكتشف على اسم الكويكب 2 بالاس، والذي تم اكتشافه قبل شهرين.[6] وجد وولاستون البلاديوم في خام البلاتين الخام من أمريكا الجنوبية عن طريق إذابة الخام في أكوا ريجيا، معادلة المحلول مع هيدروكسيد الصوديوم، والبلاتنيوم المترسب ككلورونات الأمونيوم مع كلوريد الأمونيوم، وأضاف سيانيد الزئبق الثنائي لتشكيل مركب البلاديوم (II) الساينايد، الذي تم تسخينه لاستخراج معادن البلاديوم.[3]
تم وصف كلوريد البلاديوم في وقتٍ ما بأنه علاج لمرض السل بمعدل 0.065 غرام في اليوم الواحد (حوالي مليغرام واحد لكل كيلوغرام من وزن الجسم). كان لهذا العلاج العديد من الآثار الجانبية السلبية، وتم استبداله لاحقًا بأدوية أكثر فعالية.[7]
يستخدم البلاديوم في المحولات الحفزية في صناعة السيارات.[8] في الفترة الممتدة حتى عام 2000، تأخر تقديم الروس للبلاديوم إلى السوق العالمية بشكل متكرر لأسباب سياسية، ولم يتم منح حصص التصدير في الوقت المناسب. أدى الهلع الذي أعقب ذلك إلى ارتفاع السعر إلى أعلى مستوى له على الإطلاق عند 1100 دولار للأونصة الواحدة في يناير 2001.[9] في ذلك الوقت، قامت شركة فورد للسيارات بتخزين البلاديوم؛ خوفًا من أن يتضرر إنتاج السيارات بسبب نقص في البلاديوم.[10] عندما انخفضت الأسعار في أوائل عام 2001 ، خسرت فورد ما يقرب من 1 مليار دولار أمريكي.[11]
ارتفع الطلب العالمي على البلاديوم من 100 طن في عام 1990 إلى ما يقرب من 300 طن في عام 2000. بلغ الإنتاج العالمي للبلاديوم من المناجم 222 طن في عام 2006 وفقًا لما ورد عن هيئة المسح الجيولوجي الأمريكية.[12] شعر الكثيرون بالقلق حيال الإمداد الثابت للبلاديوم في أعقاب المناورات العسكرية الروسية في أوكرانيا، حيث كانت العقوبات جزئيًا تعوق صادرات البلاتين الروسية. اعتُقد أن أي قيود على صادرات البلاديوم الروسية ستؤدي إلى تفاقم ما يتوقع أن يكون عجزًا كبيرًا في البلاديوم في عام 2014.[13] دفعت هذه المخاوف أسعار البلاديوم إلى أعلى مستوى لها منذ عام 2001.[14] في سبتمبر 2014، ارتفعت أسعارها إلى ما فوق 900 دولار للأوقية. وفي عام 2016 ، تكلف البلاديوم حوالي 614 دولارًا للأونصة بينما تمكنت روسيا من الحفاظ على إمدادات مستقرة.[15] في يناير 2018، ارتفعت العقود الآجلة للبلاديوم إلى ما يزيد عن 1100 دولار للأونصة للمرة الأولى على الإطلاق، ويرجع ذلك أساسًا إلى الطلب القوي من صناعة السيارات.[16]
أماكن تواجده
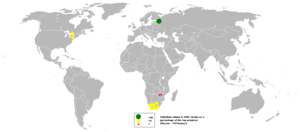
بلغ إجمالي إنتاج الألغام في البلاديوم 208,000 كيلوغرام في عام 2016، وكانت روسيا أكبر منتج ب 82000 كيلوجرام، تليها جنوب إفريقيا وكندا والولايات المتحدة.[17] تحتل شركة نورليسك للنيكل Norilsk Nickel في روسيا المرتبة الأولى بين أكبر منتجي البلاديوم على مستوى العالم، وتمثل 39٪ من الإنتاج العالمي.[18]
يمكن العثور على البلاديوم كمعدن معدني مخلوط بالذهب والمعادن الأخرى من مجموعة البلاتين في رواسب الجبس في جبال الأورال، وأستراليا، وإثيوبيا، وأمريكا الشمالية وأمريكا الجنوبية. تلعب تلك الودائع دورًا ثانويًا فقط في إنتاج البلاديوم. أهم المصادر التجارية هي النيكل - النحاس الموجود في حوض سودبوري، بأونتاريو، ونوريلسك - تالاخ في سيبيريا. يتمثل المخزون الكبير الآخر في مجموعة المعادن التابعة لمجموعة "مرينسكي ريف" البلاتينية في مجمع بوشفيلد أيجنس الجنوب أفريقي. يُعتبر مجمع ستيلووتر الناري في مونتانا وجسم منطقة روبي في مجمع لاك ديس الناري في أونتاريو هما المصدران الآخران للبلاديوم في كندا والولايات المتحدة.[12][19] يُصنف البلاديوم كأحد المعادن النادرة.[20][21][22]
كما يتم إنتاج البلاديوم في مفاعلات انشطارية نووية ويمكن استخراجه من الوقود النووي المستهلك، على الرغم من عدم استخدام هذا المصدر للبلاديوم. لم يتم تجهيز أي من مرافق إعادة المعالجة النووية الحالية لاستخراج البلاديوم من النفايات المشعة عالية المستوى.[23]
السُميّة
يُعتبر البلاديوم معدن ذو سمية منخفضة. يتم امتصاصه بشكل سيئ من قبل جسم الإنسان عند تناوله. تموت النباتات مثل ورد النيل سميك الساق بمستويات منخفضة من أملاح البلاديوم، ولكن تتحمله معظم النباتات الأخرى، على الرغم من أن الاختبارات تشير إلى تأثُّر النمو عند مستويات أعلى من 0.0003 ٪. يمكن أن تكون الجرعات العالية من البلاديوم سامة؛ تشير بعض الاختبارات على القوارض إلى أنها قد تكون مسرطنة، على الرغم من عدم وجود دليل واضح يشير إلى أن العنصر يضر البشر.[24]
الاحتياطات
يُعتبر الجزء الأكبر من البلاديوم مثل غيره من المعادن البلاتينية خامل تمامًا. على الرغم من الإبلاغ عن بعض حالات التهاب الجلد التماسي بسبب التعرض للبلاديوم، إلا أن البيانات المتعلقة بالتأثيرات محدودة. وقد تبين أن الأشخاص الذين لديهم رد فعل تحسسي للبلاديوم يتفاعلون أيضًا مع النيكل، مما يجعل من المستحسن تجنب استخدام سبائك الأسنان التي تحتوي على البلاديوم في أولئك الذين يُعانون من الحساسية.[8][25][26][27][28]
ينبعث بعض البلاديوم مع غازات العادم للسيارات ذات المحولات الحفزية. يتم إطلاق ما بين 4 و 108 نانوغرام / كم من جسيمات البلاديوم بواسطة هذه السيارات، في حين يقدر إجمالي الامتصاص من الغذاء بأقل من 2 ميكروغرام للشخص في اليوم.تأتي عمليات ترميم الأسنان في المركز الثاني للمصادر المُمكنة للتعرض للبلاديوم، والذي يقدر أن امتصاص البلاديوم أقل من 15 ميكروغرام للشخص الواحد في اليوم. قد يكون لدى الأشخاص الذين يعملون مع البلاديوم أو مركباته امتصاص أكبر بكثير.يتخلص الجسم من 99 ٪ من المركبات القابلة للذوبان مثل كلوريد البلاديوم في غضون 3 أيام.[8]
تُقدّر الجرعة المميتة المتوسطة (LD50) من مركبات البلاديوم القابلة للذوبان في الفئران هي 200 مجم / كجم للفم (عن طريق الفم) و 5 مغ / كغ للإعطاء عن طريق الوريد.[8]
النظائر
للبالاديوم 42 نظير معروف، يتراوح عددها الكتلي A ما بين 91 إلى 128، ستة منها مستقرة:108Pd ،106Pd،105Pd،104Pd، 102Pd 110Pd، هذه النظائر الستة تشكل البالاديوم الطبيعي بنسب تتراوح ما بين 1 إلى %27. وحدة الكتلة الذرية للبالاديوم هي: 106,42u .
| النظير | الوفرة الطبيعية |
|---|---|
| 102Pd | 1.02% |
| 104Pd | 11.14% |
| 105Pd | 22.33% |
| 106Pd | 27.33% |
| 108Pd | 26.46% |
| 110Pd | 11.72% |
يعتبر 107Pd النظير المشع الأكثر إستقرارا مع عمر النصف يساوي 6.5 مليون سنة.
المصادر
https://uqu.edu.sa/page/ar/53341
المراجع
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ أ ب Usselman، Melvyn (1978). "The Wollaston/Chenevix controversy over the elemental nature of palladium: A curious episode in the history of chemistry". Annals of Science. ج. 35 ع. 6: 551–579. DOI:10.1080/00033797800200431.
- ^ أ ب Griffith, W. P. (2003). "Rhodium and Palladium – Events Surrounding Its Discovery". Platinum Metals Review. ج. 47 ع. 4: 175–183. مؤرشف من الأصل في 2011-09-27.
- ^ Wollaston، W. H. (1804). "On a New Metal, Found in Crude Platina". المعاملات الفلسفية للجمعية الملكية. ج. 94: 419–430. DOI:10.1098/rstl.1804.0019. مؤرشف من الأصل في 2020-01-25.
- ^ Wollaston، W. H. (1805). "On the Discovery of Palladium; With Observations on Other Substances Found with Platina". المعاملات الفلسفية للجمعية الملكية. ج. 95: 316–330. DOI:10.1098/rstl.1805.0024.
- ^ Hammond, C. R. (2004). "The Elements". Handbook of Chemistry and Physics (ط. 81st). CRC press. ISBN:0-8493-0485-7. مؤرشف من الأصل في 2019-12-17.
- ^ Garrett، Christine E.؛ Prasad, Kapa (2004). "The Art of Meeting Palladium Specifications in Active Pharmaceutical Ingredients Produced by Pd-Catalyzed Reactions". Advanced Synthesis & Catalysis. ج. 346 ع. 8: 889–900. DOI:10.1002/adsc.200404071.
- ^ أ ب ت ث Kielhorn، Janet؛ Melber، Christine؛ Keller، Detlef؛ Mangelsdorf، Inge (2002). "Palladium – A review of exposure and effects to human health". International Journal of Hygiene and Environmental Health. ج. 205 ع. 6: 417–32. DOI:10.1078/1438-4639-00180. PMID:12455264.
- ^ Williamson، Alan. "Russian PGM Stocks" (PDF). The LBMA Precious Metals Conference 2003. The London Bullion Market Association. مؤرشف من الأصل (PDF) في 2013-10-21. اطلع عليه بتاريخ 2010-10-02.
- ^ "Ford fears first loss in a decade". BBC News. 16 يناير 2002. مؤرشف من الأصل في 2003-04-23. اطلع عليه بتاريخ 2008-09-19.
- ^ "Historical Palladium Prices and Price Chart". InvestmentMine. مؤرشف من الأصل في 2018-06-29. اطلع عليه بتاريخ 2015-01-27.
- ^ أ ب "Platinum-Group Metals" (PDF). Mineral Commodity Summaries. الماسح الجيولوجي الأمريكي. يناير 2007. مؤرشف من الأصل (PDF) في 2017-07-09.
- ^ Nat Rudarakanchana (27 مارس 2014). "Palladium Fund Launches In South Africa, As Russian Supply Fears Warm Prices". International Business Times. مؤرشف من الأصل في 2018-06-29.
- ^ Rosenfeld، Everett (20 أغسطس 2014). "The other commodity that's leaping on Ukraine war". CNBC. مؤرشف من الأصل في 2018-06-29. اطلع عليه بتاريخ 2018-01-29.
- ^ "Palladium Rally Is About More Than Just Autos". Bloomberg.com (بEnglish). 30 Aug 2017. Archived from the original on 2018-06-29. Retrieved 2018-01-29.
- ^ "Don't Expect Palladium Prices To Plunge | OilPrice.com". OilPrice.com (بEnglish). Archived from the original on 2018-01-29. Retrieved 2018-01-29.
- ^ "USGS Minerals Information: Mineral Commodity Summaries". minerals.usgs.gov (بEnglish). Archived from the original on 2018-06-08. Retrieved 2018-01-29.
{{استشهاد ويب}}:|archive-date=/|archive-url=timestamp mismatch (help) - ^ "«Norilsk Nickel» Group announces preliminary consolidated production results for 4 th quarter and full 2016, and production outl". Nornickel (بen-US). Archived from the original on 2018-01-29. Retrieved 2018-01-29.
{{استشهاد ويب}}: صيانة الاستشهاد: لغة غير مدعومة (link) - ^ "Platinum-Group Metals" (PDF). Mineral Yearbook 2007. الماسح الجيولوجي الأمريكي. يناير 2007. مؤرشف من الأصل (PDF) في 2017-07-09.
- ^ Verryn، Sabine M. C.؛ Merkle، Roland K. W. (1994). "Compositional variation of cooperite, braggite, and vysotskite from the Bushveld Complex". Mineralogical Magazine. ج. 58 ع. 2: 223–234. Bibcode:1994MinM...58..223V. DOI:10.1180/minmag.1994.058.391.05.
- ^ Genkin، A. D.؛ Evstigneeva، T. L. (1986). "Associations of platinum- group minerals of the Norilsk copper-nickel sulfide ores". Economic Geology. ج. 8l ع. 5: 1203–1212. DOI:10.2113/gsecongeo.81.5.1203.
- ^ Mindat.org - Mines, Minerals and More نسخة محفوظة 21 ديسمبر 2018 على موقع واي باك مشين.
- ^ Kolarik، Zdenek؛ Renard، Edouard V. (2003). "Recovery of Value Fission Platinoids from Spent Nuclear Fuel. Part I PART I: General Considerations and Basic Chemistry" (PDF). Platinum Metals Review. ج. 47 ع. 2: 74–87. مؤرشف من الأصل (PDF) في 2015-09-24.
- ^ Emsley، John (2011). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford University Press. ص. 384, 387. ISBN:978-0-19-960563-7. مؤرشف من الأصل في 2022-03-08.
- ^ Zereini، Fathi؛ Alt، Friedrich (2006). "Health Risk Potential of Palladium". Palladium emissions in the environment: analytical methods, environmental assessment and health effects. Springer Science & Business. ص. 549–563. ISBN:978-3-540-29219-7. مؤرشف من الأصل في 2020-01-25.
{{استشهاد بكتاب}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - ^ Wataha، J. C.؛ Hanks، C. T. (1996). "Biological effects of palladium and risk of using palladium in dental casting alloys". Journal of Oral Rehabilitation. ج. 23 ع. 5: 309–20. DOI:10.1111/j.1365-2842.1996.tb00858.x. PMID:8736443.
- ^ Aberer، Werner؛ Holub، Henriette؛ Strohal، Robert؛ Slavicek، Rudolf (1993). "Palladium in dental alloys – the dermatologists' responsibility to warn?". Contact Dermatitis. ج. 28 ع. 3: 163–5. DOI:10.1111/j.1600-0536.1993.tb03379.x. PMID:8462294.
- ^ Wataha، John C.؛ Shor، Kavita (2010). "Palladium alloys for biomedical devices". Expert Review of Medical Devices. ج. 7 ع. 4: 489–501. DOI:10.1586/erd.10.25. PMID:20583886.
| في كومنز صور وملفات عن: بالاديوم |
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||


