تشيب-إكسو
هذه مقالة غير مراجعة. (مايو 2020) |
سير عمل رقاقة- EXO: إن تشيب-اكسو هي طريقة تعتمد على الهيموغلوبين المناعي للكروماتين لرسم خرائط المواقع التي يرتبط فيها بروتين مهم (عامل النسخ) بالجينوم.
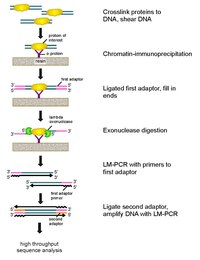
إنه تعديل لبروتوكول ChIP-seq ، مما يحسن دقة مواقع الربط من مئات أزواج القواعد إلى زوج أساسي واحد تقريبًا.
وهي تستخدم استخدام نوكليازات خارجية لتحلل خيوط الحمض النووي المرتبط بالبروتين في اتجاه 5'-3 'إلى عدد صغير من النيوكليوتيدات في موقع ربط البروتين.
يتم تحديد النيوكليوتيدات من النهايات المعالجة بالخلايا الخارجية باستخدام مزيج من تسلسل الحمض النووي والمصفوفات الدقيقة و PCR. ثم يتم تعيين هذه التسلسلات للجينوم لتحديد المواقع على الجينوم الذي يرتبط فيه البروتين.
النظرية
تم استخدام تقنيات Chromatin Immunoprec هطول (ChIP) منذ عام[1] 1984, للكشف عن تفاعلات البروتين والحمض النووي.
كانت هناك العديد من الاختلافات في ChIP لتحسين جودة النتائج. أحد هذه التحسينات ، ChIP-on-chip. (ChIP-chip) يجمع بين ChIP وتكنولوجيا microarray. هذه التقنية لها حساسية وخصوصية محدودة ، خاصة في الجسم الحي حيث تكون المصفوفات الدقيقة مقيدة بآلاف البروتينات الموجودة في الحجرة النووية ، مما يؤدي إلى ارتفاع معدل الإيجابيات الخاطئة.[2]
بعد ذلك جاء تسلسل ChIP
(ChIP-seq) ، الذي يجمع بين ChIP والتسلسل عالي الإنتاجية.[3]
ومع ذلك ، فإن الطبيعة غير المتجانسة لأجزاء الحمض النووي المنفصمة تُعيِّن مواقع الربط ضمن ± 300 زوج أساسي ، مما يحد من الخصوصية. ثانيًا ، يمثل تلوث الحمض النووي مشكلة خطيرة نظرًا لقلة عدد المواقع الوراثية المرتبطة بالبروتين المعني ، مما يجعل أي DNA جينومي غير محدد مصدرًا مهمًا للضوضاء في الخلفية.[4]
لمعالجة هذه المشاكل ، قام كل من Rhee و Pugh بمراجعة فحص حماية nuclease الكلاسيكي لتطوير ChIP-exo.[5]
تعتمد تقنية ChIP الجديدة على نوكلياز لامدا الذي يتحلل فقط ، وجميع ، حمض نووي ريبوزي منقوص الأكسجين غير المحصور المزدوج المجدول في اتجاه 5′-3.
باختصار ، يتم ربط بروتين مهم (هندسة برمز epitope يمكن أن يكون مفيدًا للتساقط المناعي) في الجسم الحي إلى مواقع الارتباط الطبيعية عبر الجينوم باستخدام الفورمالديهايد. يتم بعد ذلك جمع الخلايا وفتحها وتقطيع الكروماتين وإذابته بواسطة الصوتنة.
يتم بعد ذلك استخدام الجسم المضاد لاستئصال البروتين المناعي ، جنبًا إلى جنب مع DNA المتشابك. ثم يتم ربط محولات DNA PCR إلى النهايات ، والتي تعمل كنقطة تحضير لتوليف DNA للحبل الثاني بعد عملية الهضم النوكليزي.
ثم يفرز نوكلياز لامدا من خيوط الحمض النووي المزدوج من نهاية ′5 حتى يتم حظر الهضم عند حدود التفاعل التساهمي بين البروتين والحمض النووي.
يتحلل معظم الحمض النووي الملوث عن طريق إضافة نوكلياز خارجي أحادي السلسلة. بعد عكس الارتباط المتبادل ، يتم تمديد البادئات إلى محولات PCR لتشكيل DNA مزدوج مجدولة ، ويتم ربط المحول الثاني حتى 5 ′ لترسيم الموقع الدقيق لوقف الهضم الخارجي.
ثم يتم تضخيم المكتبة بواسطة PCR ، ويتم تحديد المنتجات عن طريق تسلسل الإنتاجية العالية. تسمح هذه الطريقة بدقة تصل إلى زوج أساسي واحد لأي موقع ربط بروتين داخل أي جينوم ، وهو دقة أعلى بكثير من إما رقاقة ChIP أو C⅝hIP-seq.
المزايا
لقد ثبت أن ChIP-exo يتخلى عن حل زوجي أساسي واحد في تحديد مواقع ربط البروتين. هذا على النقيض من ChIP-seq الذي يمكنه تحديد موقع ارتباط البروتين فقط بـ ± 300 زوج أساسي
يمكن أن يؤدي تلوث أجزاء الحمض النووي غير المرتبطة بالبروتين إلى معدل مرتفع من الإيجابيات والسلبيات الكاذبة في تجارب رقاقة. لا تؤدي إضافة الإينوكليازات إلى العملية إلى تحسين دقة استدعاء موقع الارتباط فحسب ، بل تزيل تلوث DNA من المحلول قبل التسلسل.
من المرجح أن يتم الكشف عن البروتينات المرتبطة بشكل غير فعال بشظية النيوكليوتيد بواسطة ChIP-exo. وقد سمح ذلك ، على سبيل المثال ، بالتعرف على المزيد من مواقع ربط عامل النسخ CTCF مما تم اكتشافه سابقًا.
نظرًا لوجود دقة أعلى وخلفية أقل ، هناك حاجة إلى عمق أقل للتسلسل عند استخدام ChIP-exo.
المحددات
إذا كان مركب البروتين DNA يحتوي على مواقع متعددة للربط المتبادل داخل حدث ربط واحد ، فيمكن أن يظهر كما لو كان هناك العديد من أحداث الربط المميزة. ينتج هذا على الأرجح عن تشويه هذه البروتينات وربطها المتبادل في أحد مواقع الربط المتاحة في نفس الحدث. ثم يتوقف الإينوكلياز عند أحد المواقع المرتبطة ، اعتمادًا على الموقع الذي يرتبط فيه البروتين بالتبادل. كما هو الحال مع أي طريقة قائمة على رقاقة ، يجب أن يكون الجسم المضاد المناسب للبروتين موضع الاهتمام متاحًا لاستخدام هذه التقنية.
التطبيقات
يقدم Rhee و Pugh ChIP-exo من خلال إجراء تحليلات على مجموعة صغيرة من عوامل النسخ: Reb1 و Gal4 و Phd1 و Rap1 في الخميرة و CTCF في الإنسان.
غالبًا ما تم العثور على مواقع Reb1 في العناقيد وكان لهذه المجموعات إشغالًا أعلى بعشر مرات مما كان متوقعًا. تم العثور على مواقع ثانوية في مجموعات ~ 40 نقطة أساس من موقع ربط أساسي. أظهرت الزخارف الملزمة لـ Gal4 تفضيلًا قويًا لثلاثة من النيوكليوتيدات الأربعة ، مما يشير إلى تفاعل سلبي بين Gal4 والنوكليوتيدات المستبعدة. يدرك Phd1 ثلاثة أشكال مختلفة تشرح التقارير السابقة عن غموض فكرة الربط لـ Phd1. تم العثور على Rap1 للتعرف على أربعة أشكال.
تميل جينات البروتين الريبوزومي المرتبطة بهذا البروتين إلى استخدام عزر معين بتسلسل إجماع أقوى. غالبًا ما استخدمت جينات أخرى مجموعات من زخارف إجماع أضعف ، ربما لتحقيق شغل مماثل. استخدمت الأشكال الملزمة من CTCF أربع «وحدات». استخدم نصف مواقع CTCF المقيدة الوحدات 1 و 2 ، بينما استخدم الباقي مزيجًا من الأربعة. ويعتقد أن CTCF تستخدم أصابع الزنك للتعرف على مجموعات مختلفة من هذه الوحدات.إغلاق </ref> مفقود لوسم <ref>
المحددات
إذا كان مركب البروتين DNA يحتوي على مواقع متعددة للربط المتبادل داخل حدث ربط واحد ، فيمكن أن يظهر كما لو كان هناك العديد من أحداث الربط المميزة. ينتج هذا على الأرجح عن تشويه هذه البروتينات وربطها المتبادل في أحد مواقع الربط المتاحة في نفس الحدث. ثم يتوقف الإينوكلياز عند أحد المواقع المرتبطة ، اعتمادًا على الموقع الذي يرتبط فيه البروتين بالتبادل<ref>name="ChIP-exo patent"وسم الفتح <ref> غير صحيح أو له اسم سييء.
كما هو الحال مع أي طريقة قائمة على رقاقة ، يجب أن يكون الجسم المضاد المناسب للبروتين موضع الاهتمام متاحًا لاستخدام هذه التقنية.
التطبيقات
يقدم Rhee و Pugh ChIP-exo من خلال إجراء تحليلات على مجموعة صغيرة من عوامل النسخ: Reb1 و Gal4 و Phd1 و Rap1 في الخميرة و CTCF في الإنسان.
غالبًا ما تم العثور على مواقع Reb1 في العناقيد وكان لهذه المجموعات إشغالًا أعلى بعشر مرات مما كان متوقعًا. تم العثور على مواقع ثانوية في مجموعات ~ 40 نقطة أساس من موقع ربط أساسي. أظهرت الزخارف الملزمة لـ Gal4 تفضيلًا قويًا لثلاثة من النيوكليوتيدات الأربعة ، مما يشير إلى تفاعل سلبي بين Gal4 والنوكليوتيدات المستبعدة. يدرك Phd1 ثلاثة أشكال مختلفة تشرح التقارير السابقة عن غموض فكرة الربط لـ Phd1. تم العثور على Rap1 للتعرف على أربعة أشكال.
تميل جينات البروتين الريبوزومي المرتبطة بهذا البروتين إلى استخدام عزر معين بتسلسل إجماع أقوى. غالبًا ما استخدمت جينات أخرى مجموعات من زخارف إجماع أضعف ، ربما لتحقيق شغل مماثل. استخدمت الأشكال الملزمة من CTCF أربع "وحدات". استخدم نصف مواقع CTCF المقيدة الوحدات 1 و 2 ، بينما استخدم الباقي مزيجًا من الأربعة. ويعتقد أن CTCF تستخدم أصابع الزنك للتعرف على مجموعات مختلفة من هذه الوحدات.
<ref>name="Rhee"وسم الفتح <ref> غير صحيح أو له اسم سييء.
قام كل من Rhee و Pugh بتحليل هيكل وتنظيم مركب ما قبل البدء (PIC) في جينومات Saccharomyces. باستخدام ChIP-exo ، تمكنوا ، من بين اكتشافات أخرى ، من تحديد الميزات الشبيهة بـ TATA بدقة في المروجين الذين تم الإبلاغ عن أنهم أقل من TATA.[6]
انظر أيضًا
المراجع
- ^ Gilmour، DS؛ JT Lis (1983). "Detecting protein-DNA interactions in vivo: Distribution of RNA polymerase on specific bacterial genes". Proceedings of the National Academy of Sciences. ج. 81 ع. 14: 4275–4279. DOI:10.1073/pnas.81.14.4275. PMC:345570. PMID:6379641.
- ^ Albert، I؛ TN Mavrich؛ LP Tomsho؛ J Qi؛ SJ Zanton؛ SC Schuster؛ BF Pugh (2007). "Translational and rotational settings of H2A.Z nucleosomes cross the Saccharomyces cerevisiae genome". Nature. ج. 446 ع. 7135: 572–576. DOI:10.1038/nature05632. PMID:17392789.
- ^ Ren، B؛ F Robert؛ JJ Wyrick؛ O Aparicio؛ EG Jennings؛ I Simon؛ J Zeitlinger؛ J Schreiber؛ N Hannett؛ E Kan؛ وآخرون (2000). "Genome-wide location and function of DNA binding proteins". Science. ج. 290 ع. 5500: 2306–2309. CiteSeerX:10.1.1.123.6772. DOI:10.1126/science.290.5500.2306. PMID:11125145.
- ^ Pugh، Benjamin. "Methods, Systems and Kits for Detecting Protein-Nucleic Acid Interactions". United States Application Publication. United States Patents. مؤرشف من الأصل في 2018-06-16. اطلع عليه بتاريخ 2012-02-17.
- ^ Rhee، Ho Sung؛ BJ Pugh (2011). "Comprehensive Genome-wide Protein-DNA Interactions Detected at Single-Nucleotide Resolution". Cell. ج. 147 ع. 6: 1408–1419. DOI:10.1016/j.cell.2011.11.013. PMC:3243364. PMID:22153082.
- ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعRhee22