|
تضامنًا مع حق الشعب الفلسطيني |
عناصر الدورة الثانية
عناصر الدورة الثانية هي العناصر الكيميائية الموجودة في الصف الثاني (الدورة الثانية) من الجدول الدوري للعناصر.
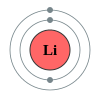
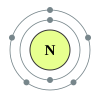
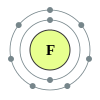
تحوي الدورة الثانية من الجدول الدوري كل من العناصر التالية: ليثيوم، بيريليوم، بورون، كربون، نيتروجين، أكسجين، فلور، نيون. ما يجمع هذه العناصر هو وجود صفات مشتركة في بنية الذرّة، حيث أنّه حسب ميكانيكا الكم، فإن إلكترونات الغلاف الخارجي لهذه العناصر تملأ المدارات الذرّيّة للمستويات الفرعية 2s و 2p. تتبع عناصر الدورة الثانية قاعدة الثمانيات، بحيث أنّها تحتاج ثمانية إلكترونات لملء غلاف التكافؤ. إنّ العدد الأقصى من الإلكترونات الذي يمكن أن يحوزه عنصر من عناصر الدورة الثانية هو عشرة، وهو لعنصر النيون، الغاز النبيل الخامل، حيث يوجد إلكترونين اثنين في المدار 1s، واثنين في المدار 2s، وستة في المدار 2p. إنّ جميع عناصر الدورة الثانية هي ثنائيّة الذرّة، ما عدا البيريليوم والنيون.
الخصائص الدوريّة

عند ازدياد العدد الذرّي لعناصر الدورة الثانية، أي عند الانتقال من اليسار لليمين على طول الدورة، فإن نصف قطر الذرّي للعناصر يتناقص، وتزداد الكهرسلبية وطاقة التأيّن.[1]
تحوي عناصر الدورة الثانية على فلزّين فقط، وهما الليثيوم والبيريليوم، ممّا يجعل من هذه الدورة أقلّ دورة في الجدول الدوري بعد دورة عناصر الدورة الأولى من حيث عدد الفلزات فيها (2)، وأكثرها من عدد اللا فلزات (4).
إنّ عناصر الدورة الثانية غالباً ما يكون لها خصائص مفضّلة ضمن مجموعاتها الموافقة؛ فعلى سبيل المثال، إنّ الفلور هو الأكثر نشاطاً كيميائياً من بين الهالوجينات، والنيون الأكثر خمولاً من بين الغازات النبيلة، والليثيوم هو الأقل من حيث النشاط الكيميائي من بين الفلزّات القلويّة.[2]
تتبع عناصر الدورة الثانية مبدأ أوفباو (قاعدة ماديلونغ) من حيث الترتيب الإلكتروني في ملء المدارات الذريّة. فتملأ الإلكترونات المدار 2s في الليثيوم والبيريليوم، في حين أن الإلكترونات تملأ المدارين 2s و 2p في البورون والكربون والنيتروجين والأكسجين والفلور والنيون.
العناصر
- ff6666"
- ffdead"
- cccc99"
- a1ffc3"
- e7ff8f"
- e7ff8f"
- e7ff8f"
- c0ffff"
العنصر الكيميائي المجموعة التوزيع الإلكتروني 3 Li ليثيوم فلز قلوي He] 2s1] 4 Be بيريليوم فلز قلوي ترابي He] 2s2] 5 B بورون شبه فلز He] 2s2 2p1] 6 C كربون لا فلز متعدد الذرّة He] 2s2 2p2] 7 N نيتروجين لا فلز ثنائي الذرّة He] 2s2 2p3] 8 O أكسجين لا فلز ثنائي الذرّة He] 2s2 2p4] 9 F فلور لا فلز ثنائي الذرّة He] 2s2 2p5] 10 Ne نيون غاز نبيل He] 2s2 2p6]
المراجع
- ^ Masterson، William؛ Hurley، Cecile (2009). Chemistry: Principles and reactions (ط. sixth). Belmont, CA: Brooks/Cole Cengage Learning. ص. 24–42. ISBN:978-0-495-12671-3. مؤرشف من الأصل في 2022-04-22.
- ^ Gray، Theodore (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. New York: Black Dog & Leventhal Publishers. ISBN:978-1-57912-814-2. مؤرشف من الأصل في 2022-05-31.
| عناصر الدورة الثانية في المشاريع الشقيقة: | |